Innhold: Kronisk inflammatorisk tarmsjukdom - IBD
Kronisk inflammatorisk tarmsjukdom - IBD
Definitioner
Sjukdomsgruppen IBD innefattar ulcerös kolit (UC) – inklusive ulcerös proktit – och Crohns sjukdom (CD). Dessutom ingår så kallad obestämbar kolit (”IBD-U, Undefined”) – där det otvetydigt föreligger en inflammatorisk tarmsjukdom, men det ej kunnat fastställas vilket tillstånd som föreligger, UC eller CD. En annan undergrupp är de så kallade mikroskopiska koliterna (MC, kollagen och lymfocytär kolit) vilka endast översiktligt behandlas i denna framställning. IBD är tillstånd med kronisk inflammation av okänd genes. Vanligen går IBD med perioder av ökad aktivitet (skov), men ibland är inflammationen kroniskt kontinuerligt aktiv. Vid UC är företrädesvis slemhinnan (mukosan) i kolon och rektum inflammerad – vid ulcerös proktit är enbart rektum engagerad. Hela mag-tarmkanalen, från mun till anus, kan vara drabbad vid CD och ofta är hela tarmväggen angripen.
Inflammationen ger upphov till symptom som diarré, ofta med blod- eller slemtillblandning, viktnedgång p.g.a. malabsorption och malnutrition, allmän sjukdomskänsla och ibland feber. Typiskt är att även manifestationer från andra organsystem än mag-tarmkanalen kan förekomma.
Specifika diagnostiska kriterier för IBD saknas, men efter uteslutande av andra åkommor, framför allt infektioner, kan en sannolikhetsdiagnos ställas på basen av typiska kliniska, endoskopiska, histologiska och ibland även radiologiska (DT/MR) fynd. Finns inflammation i övre gastrointestinal-kanalen (GI-kanalen) och/eller tunntarmen i kombination med fistlar och ett positivt fynd av granulom vid histologisk bedömning av biopsier talar detta mycket starkt för CD (Tabell 1).
Tabell 1. Lennard-Jones kriterier för CD
Utbredning
+ Även övre GI-kanalen
+ Anus
+ Diskontinuerlig
Transmuralt engagemang
+ Fissurerande sår
+ Abscesser
+ Fistlar
Fibros
+ Strikturer
Histologi
+ Lymfoida sår
+ Lymfoid hyperplasi
+ Normala kryptor
+ + Granulom
För säker diagnos krävs antingen 3 st + eller 1 st + och 1 st + + (granulom) konstaterade med klinik, endoskopi, biopsier, radiologi eller operationspreparat. Fynd av 2 st + gör diagnosen trolig.
Epidemiologi
IBD är vanligare i städer än på landsbygden, vanligare i Nordeuropa och Nordamerika än exempelvis i Sydeuropa, och vanligare i I-länder jämfört med U-länder. Den stigande IBD-förekomsten (såväl incidens som prevalens) kan följas i spåren av ökad levnadsstandard och ändrade livsstilsvanor
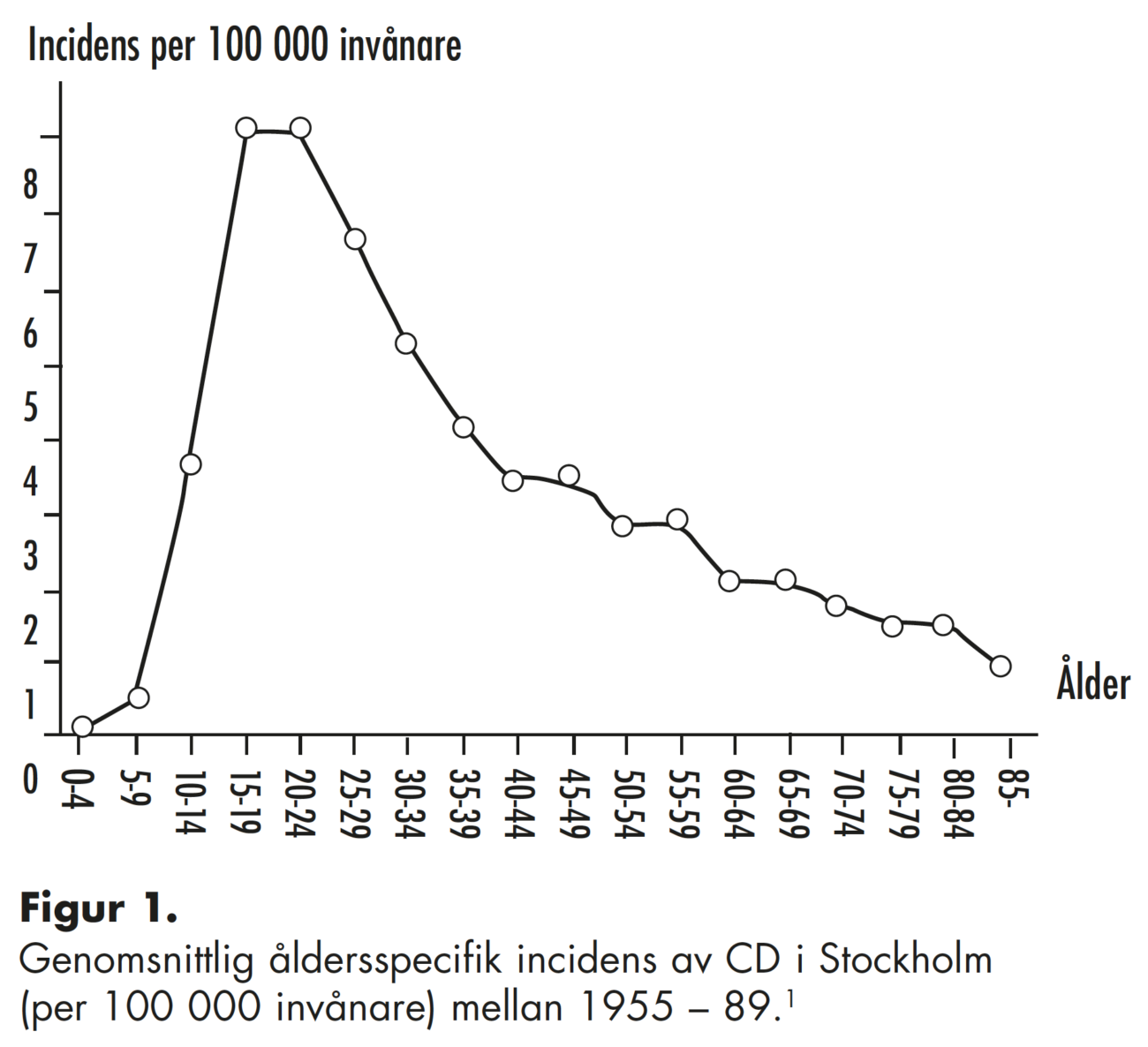
framför allt i USA/Kanada och Nordeuropa efter andra världskriget. Även om vi nu kan se vissa epidemiologiska tecken på att IBD-incidensen minskar t.ex. i östra Kanada, har den stigit mycket kraftigt i Japan och Kina – länder som tidigare varit helt förskonade från kroniska tarminflammationer. I Sverige har incidensen för UC stigit gradvis sedan 1940-talet och den senaste statistiken visar en nivå på 20 nya fall per 100 000 invånare i Uppsalaregionen. Incidensen för CD verkar även den fortsätta att öka, särskilt i de yngsta åldrarna. Den åldersspecifika incidenstoppen för CD är högst bland dem som är i dryga tjugoårsåldern vid insjuknandet (ca 23 nya fall per 100 000 invånare/år). Eftersom incidensen är högst bland unga människor ser vi nu en ackumulering av fall med IBD och därmed allt högre prevalenssiffror.
Den senaste svenska statistiken fram till år 2011 visade att 61344 patienter hade åtminstone två besök hos vårdgivare p.g.a. en IBD-diagnos, där 54 % hade UC, 30 % CD och resterande 16 % uppvisade en blandning av de två diagnoserna (obestämbar kolit). Dessa beräkningar ger en total IBD-prevalens på 0,65 % i Sverige 2011. Med tillägg av patienter som tidigare opererats p.g.a. IBD (t.ex. ileostomi/ panproktokolektomi), alla oklara fall samt den betydande gruppen med mikroskopisk kolit (MC) närmar sig den totala prevalensen 1 %.
Immunopatogenes och etiologi
Orsakerna bakom CD och UC är fortfarande okända. Den fundamentala frågan är om inflammationen i tarmslemhinnan är ett inadekvat immunologiskt svar på ett vanligt förekommande stimulus (t.ex. mikroorganism, födoämne eller annat luminalt antigen), eller om inflammationen är resultatet av en adekvat reaktion på något ovanligt eller hittills okänt agens. Helt klart är att arv och miljö samspelar. Tvillingstudier har pekat på en genetisk konkordans särskilt vid CD. Ca 10 % av barnen till föräldrar med CD löper risk att få IBD vilket är mer än 10 gånger den förväntade risken. Vid UC är det genetiska sambandet svagare. Idag har över 240 olika genloci associerats till IBD.Inflammationen
Både CD och UC karakteriseras av kontinuerligt pågåendeinflammatorisk aktivitet i tarmslemhinnan med immunceller från både det medfödda och det adaptiva immunsystemet. Dessa celler produceras i benmärgen och tar sig till den inflammerade tarmen genom blodcirkulationen och lymfvägar via ”homing”– receptorer och adhesionsmolekyler. Det medfödda immunsystemet består av cirkulerande monocyter, som blir makrofager när de anländer till tarmen, samt granulocyter. Även dendritiska celler som återfinns i tarmslemhinnan har liknande funktion som makrofager och är en del av den medfödda immuniteten. Dock är man osäker på de dendritiska cellernas cirkulerande motsvarighet. Tack vare att det medfödda immunsystemet kan känna igen generella ytstrukturer som är gemensamma för flera olika patogener aktiveras dessa immunceller relativt omgående vid invasion av främmande agens. Både makrofager och dendritiska celler har som huvuduppgift att fagocytera, d.v.s. ”äta upp” de invaderande mikroberna samt intracellulärt bryta ner dessa patogener och presentera deras beståndsdelar (s.k. antigen) för det adaptiva immunsystemet. I samband med antigenpresentationen frisätts även cytokiner, d.v.s. små proteiner som utgör aktiverande signalmolekyler. TNF samt interleukin 1, 6, 12 och 23 utgör viktiga cytokiner vid inflammation i tarmen. Vid antigenpresentationen aktiveras det adaptiva immunsvaret, d.v.s. T- och B-lymfocyterna. Medan det medfödda immunsvaret, ”första linjens försvar”, aktiveras inom timmar, kan den adaptiva immunaktiveringen dröja flera dagar. De adaptiva T- och B-lymfocyternas immunsvar är dock mycket specifikt för det aktuella invaderande patogenet, vilket möjliggör en mycket kraftfull eliminering av patogena mikrober i tarmens slemhinna utan att hela den normala tarmfloran slås ut.
Vid inflammatorisk tarmsjukdom har både det medfödda och det adaptiva immunsystemet aktiverats, vilket innebär att makrofager och dendritiska celler i tarmen har identifierat ett hittills okänt antigen som brutit slemhinnebarriären. De medfödda immuncellerna har aktiverats, frisatt cytokiner som lockat granulocyter och därefter naiva T- och B-lymfocyter till skadeplatsen. Granulocyterna har frisatt antibakteriella proteiner och kloner av T- och B-lymfocyter utrustade med den rätta antigenspecifika receptorn expanderar snabbt i tarmen. De två IBD-diagnoserna CD och UC skiljer sig åt immunologiskt avseende vilka immunceller som dominerar samt med delvis olika cytokinmönster.
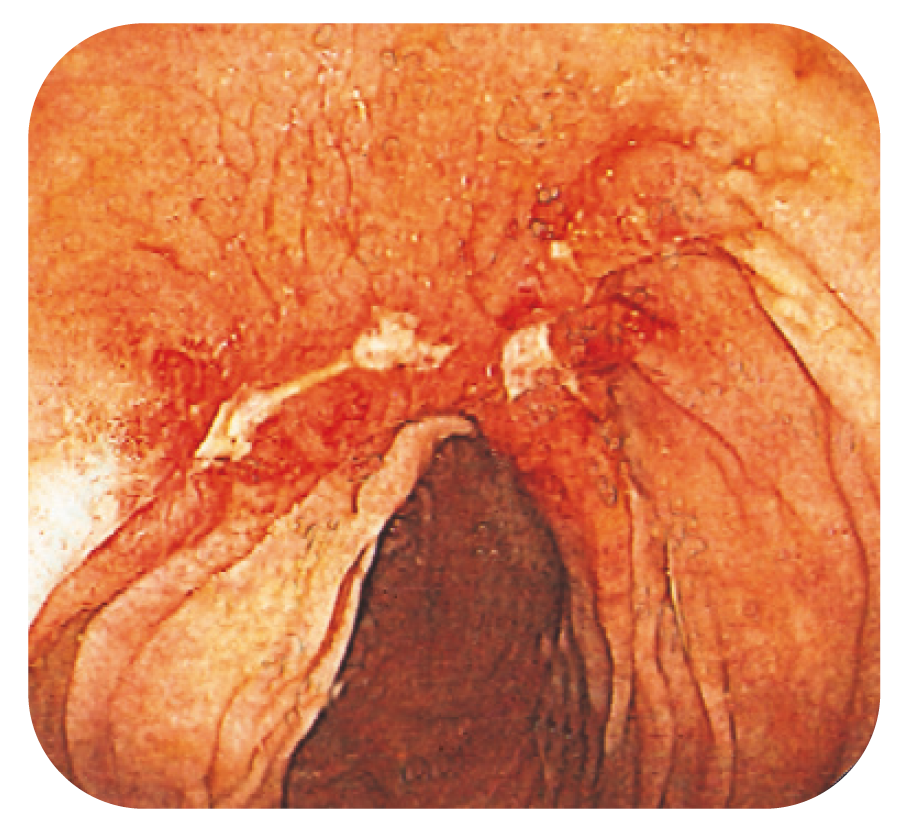
Bild 1.
Deformerad och ulcererad slemhinna vid CD.
Intestinal flora
Orsaken till immunaktiveringen vid CD och UC är fortfar-ande inte klarlagd och troligen kan flera utlösande faktorer leda till inflammatorisk tarmsjukdom. Framför allt vid CD har bakteriell genes diskuterats och forskningen pekar mer på en bakteriellt drivande inflammation än en ren autoimmun aktivering. En av de viktigaste observationerna för detta är att IBD-djurmodeller kräver närvaro av bakterier i tarmen och djur som hålls i en steril miljö från födseln utvecklar inte IBD-liknande inflammation. Vid avlastande ileostomi för CD utnyttjas det faktum att inflammerade tarmssegment kan läka om fekalströmmen stoppas. Dock återkommer inflammationen ofta när tarmen åter kopplas ihop och slem-hinnan exponeras för tarmfloran. Vi vet även att infektioner såsom akuta gastroenteriter och övre luftvägsinfektioner kan utlösa skov av IBD, antingen som en följd av direkt inverkan på tarmen eller, vilket är troligare, genom att störa funktionen av vår normala, interaktivt skyddande tarmflora som består av 1–2 kg bakterier. Förutom hypotesen att den allmänna floran i tarmlumen underhåller den inflammatoriska proces-sen, kan även vissa specifika bakterier spela en roll vid IBD. Adhesiva invaderande E. Coli (AIEC) och Mycobacterium Avium Paratuberculosis (MAP) har i vissa studier utpekats som drivande agens bakom tarminflammationen. En redu-cerad förekomst av Faecalibacterium prausnitzii-bakterier har observerats hos vissa CD-patienter och därmed kopplats till framför allt ileocekal CD. Studier har även påvisat närvaro av bakterier dikt an mot epitelet hos IBD-patienter jämfört med kontroller. Detta område närmast tarmepitelet utgörs nämligen av en relativt steril zon skyddad av ett lager slem hos friska personer. Tarmflorans betydelse för IBD betonas ytterligare av den kliniska användningen av antibiotika, där studier påvisat respons vid behandling med till exempel vissa makrolider vid framför allt CD.
Intestinal slemhinna
Störd barriärfunktion har identifierats hos patienter med IBD, vilket innebär att immunceller i tarmväggen exponeras för tarmflora och därmed aktiveras. Ökad tarmpermea-bilitet har enligt studier observerats hos upp till 25 % av förstagradssläktingar till IBD-patienter. Man har även visat att ökad intestinal permeabilitet kan föregå ett IBD-skov. Vissa genetiska varianter är kopplade till sämre barriärfunk-tion vid IBD, t.ex. punktmutationer i MDR-1 vid UC samt ett minskat uttryck i tarmepitelet av antibakteriella peptider, så kallade defensiner, vid såväl UC som CD. NSAID, som i vissa fall kan påverka tarmslemhinnan, ger upphov till extensiv påverkan på framför allt distala tunntarmen och kan både precipitera latent sjukdom och provocera nya skov vid båda formerna av IBD. Forskningen inom området försvåras av att inflammationen de facto skadar barriären. Därmed kan det vara svårt att säga om barriärskadan eller inflammationen är den drivande faktorn.
Intestinalt immunförsvar
Ytterligare en hypotes är att en primär immunologisk dysfunktion orsakar inflammatorisk tarmsjukdom. Denna teori stöds av den hittills starkaste kopplingen mellan CD och en specifik genetisk mutation, polymorfism i NOD2-genen. Denna gen kodar för en intracellulär receptor som känner igen muramyldipeptid, ett protein som är gemensamt för ett flertal bakterier. Denna receptor deltar bland annat i aktiveringen av makrofagerna när de har fagocyterat bak-terier. NOD2-genen är nedreglerad hos vissa CD-patienter och därmed skulle sjukdomen kunna vara ett resultat av ineffektiv eliminering av bakterier i tarmväggen. Denna teori har fått stöd av en klinisk studie där man påvisat sämre immunologisk reaktion mot subkutant injicerat E.coli hos CD-patienter jämfört med friska kontroller.
Forskningen har även påvisat reducerad frisättning av cytokiner hos makrofager från CD-patienter, vilket kun-nat kopplas till polymorfism i generna IRGM och ATG16L1. Denna genetiska defekt ger felaktiga posttranslationella modifieringar av makrofagens cytokiner vilket leder till intracellulär transport till lysosomer där cytokinerna bryts ner. Denna s.k. autofagi minskar frisättningen av makrofa-gens cytokiner och därmed försämras immunsvaret. Även om vissa drag vid UC kan förknippas med autoimmun sjukdom har ingen specifik antikropp påvisats. Onormal förekomst av vissa andra antikroppar förekommer dock. Två antikroppar är vanligare vid UC än CD, antikroppar mot neutrofila leukocyter (pANCA, perinuclear antineutrophi-lic cytoplasmatic antigen) samt mot ett kolonantigen. Den kliniska relevansen av dessa fynd är dock oklar.
Övriga miljöfaktorer
Icke-rökare och före detta rökare löper ökad risk att få UC. Aktiv rökning är däremot starkt korrelerad till CD. Risken att få CD är dubbelt så hög hos rökare jämfört med icke-rökare och högst för storrökare. Även riskerna för recidiv efter operation vid fortsatt rökning är kraftigt ökad. Orsakerna till detta kliniskt viktiga motsatsförhållande vad gäller rökvanor och IBD är okända, men en immunologisk påverkan har föreslagits. Vidare har flera oberoende studier visat att appendektomi ”skyddar” mot senare utveckling av UC. Det är dock en tidigare genomgången appendicit som är den viktigaste skyddsfaktorn och ej operationen i sig. Vid CD verkar förhållandet återigen vara omvänt men detta är osäkert eftersom det är vanligt att Crohndiagnosen fastställs inom ett år efter appendiciten. Möjligheten är således att Crohninflammationen har misstagits för appendicit.
