Medicinsk behandling
Medicinsk behandling
Övergripande behandlingsstrategi
För optimal medicinsk behandling vid IBD krävs att:
- Diagnos och utbredning är klarlagda.
- Aktivitetsgrad och symptombörda har fastställts.
- Eventuella kirurgiska åtgärdbara komplikationer har åtgärdats vid CD (stenosering, dränage av fistlar och abscesser).
Enligt vår och de flesta andra IBD-specialisters uppfattning i Norden bör man som generell princip utnyttja varje steg i behandlingstrappan maximalt innan man går till nästa nivå (Figur 4). Behandlingsresultatet bör därmed kontinuerligt utvärderas för att ta ställning till eventuell upptrappning. Vår erfarenhet är att denna strategi leder till adekvat symptomregress/remission inom en sexmånadersperiod i de allra flesta fall. Vid tecken på allvarlig inflammation tidigt i förloppet eller vid kontraindikationer kan behandlings-steg hoppas över för en individualiserad behandling.
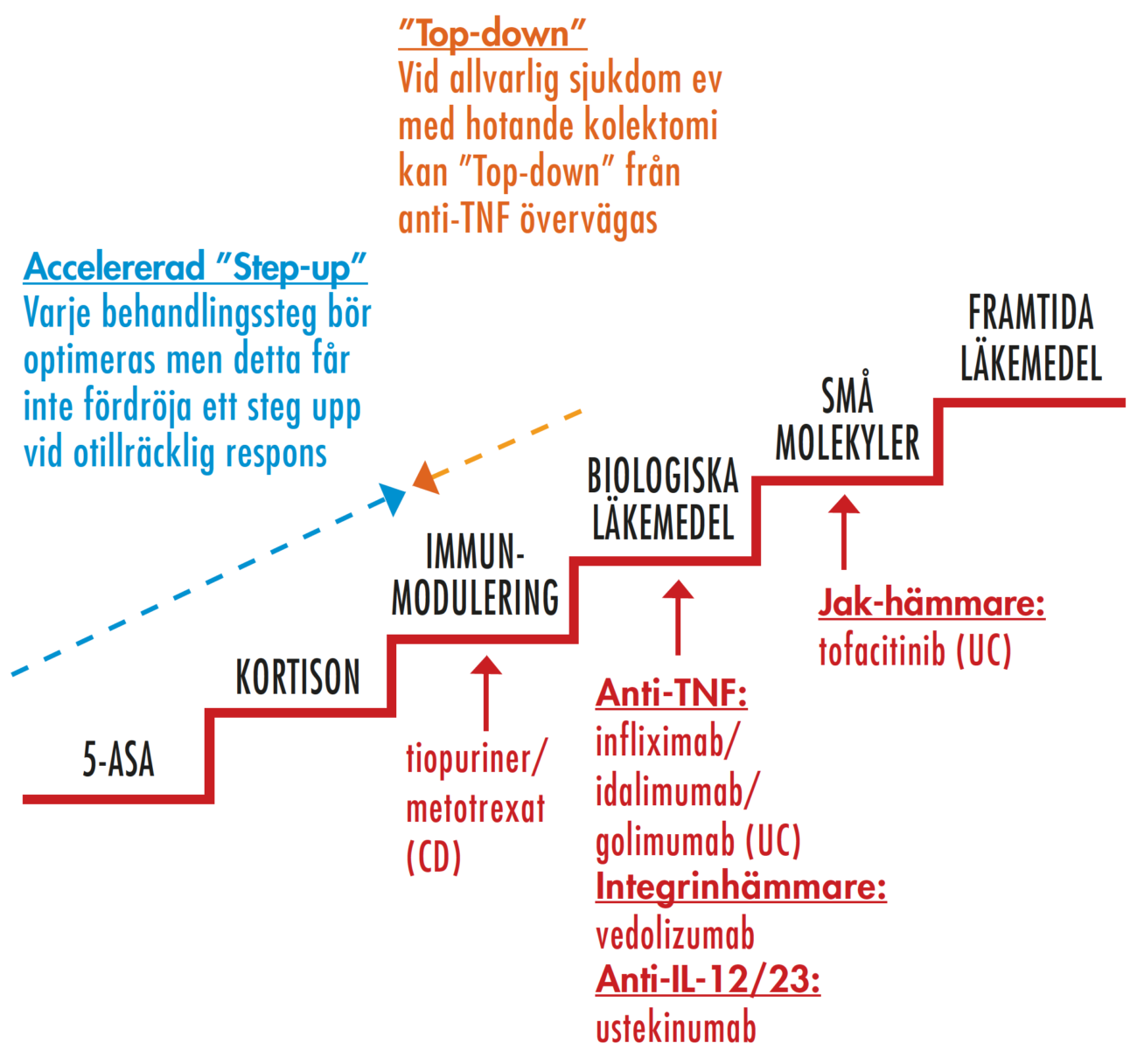
Figur 4.
Medicinsk behandling vid IBD – behandlingstrappan.
Observera att man kan ha kvar insatt 5-ASA och/eller tiopuriner/metotrexat när man går upp till biologiska läkemedel. s.k. kombinationsbehandling. Tofacitinib bör ej kombineras med tiopuriner men 5-ASA kan vara kvar. Inbördes ordning mellan de biologiska läkemedlen är ej helt vetenskapligt klarlagd utan man får utgå från tid till respons, risk för avtagande effekt av läkemedlet, erfarenhet samt kostnad. Det är aktuell situation och förutsättning för den individuella patienten som får avgöra. Om UC eller CD anges efter enskilt läkemedel begränsas indikationen till denna diagnos.
Induktions- och underhållsbehandling
Översiktligt kan man dela in behandlingen av IBD i en akut fas där man vill nå symptomreduktion och slutligen sjukdoms-remission, d. v. s. induktionsbehandling. Därefter vill man bibehålla remission med underhållsbehandling.
Tabell 14. Behandlingsalternativ vid UC och CD.

Behandlingsmål
All IBD-behandling är individualiserad, såväl val av medi-cinsk/kirurgisk behandlingsmetod som vilken målsättning som patienten och läkaren tillsammans kommer fram till. Historiskt nöjde man sig med symptomatisk kontroll av sjuk-domen eftersom möjligheterna till läkning av inflammatio-nen var begränsad. Idag är målsättningen ofta fullständig sjukdomskontroll och slemhinneläkning. Om man långsiktigt ska kunna överväga att ta bort medicineringen bör mål-sättningen histologisk remission vara uppfylld för att mini-mera risken för återfall. En utmaning är att väga fördelarna med att uppnå fullständig läkning mot nackdelarna med immunsuppression. Det kan många gånger vara utmanande att intensifiera behandlingen på grundval av endoskopisk bild när patienten är kliniskt symptomfri. Se tabell 15 för behandlingsmål.
Tabell 15. Behandlingsmål
- Symptomreduktion
- Uppnådd klinisk remission
- Steroidfrihet
- Långsiktigt bevarad steroidfri klinisk remission
- Ej behov av sjukhusvård och kirurgi
- Normaliserad livskvalitet
- Slemhinneläkning
- Histologisk läkning
Medicinsk behandling av UC
Den akuta medicinska behandlingen syftar till att med anti-inflammatoriska preparat minska aktiviteten av koliten, att uppnå symptomfrihet och i bästa fall även komplett endo-skopisk remission. Den medicinska behandlingsarsenalen vid akut UC utgörs huvudsakligen av aminosalicylater samt glukokortikosteroider (GCS).
Tillgängliga läkemedel vid UC
1. 5-Aminosalicylat
Sulfasalazin (Salazopyrin®, SASP)) är en förening mellan 5-amino-salicylsyra (5-ASA) och sulfapyridin med en azo-brygga som spjälkas av bakterier när substansen når cekum. 5-ASA absorberas dåligt från kolon och utövar där en huvud-sakligen topikal antiinflammatorisk effekt.
De moderna sulfafria 5-ASA-preparaten frisätter 5-ASA (mesalazin) i kolon antingen genom s.k. ”slow release” (Pentasa® – där frisättningen från mikrogranulat börjar redan proximalt i tunntarmen, och även Salofalk®) eller ”delayed release” (Asacol® – som har ett pH-känsligt skal). Olsalazine (Dipentum®) består av två 5-ASA-molekyler kopplade med en azobrygga och ger en liknande frisättningsprofil som den för sulfasalazin i kolon. Balsalazid (Colazid®) är mesalazin bundet med en azobrygga till en inert bärarmolekyl och spjälkas på liknande sätt som sulfasalazin och olsalazin. Mezavant® är det senaste 5-ASA-läkemedlet med ett så kallat multimatrixhölje (MMX) som innebär långsam utsöndring av mesalazin.
Pentasa Sachet® som mikrogranulatformulering i dospåsar 2/4 g har varit föregångare i att kunna ges en gång per dag i akut skede eller som remissionsprofylax. Senare har flera andra 5-ASA läkemedel, som Salofalk®, Mezavant® och relativt nyligen Asacol® kommit med studier som visar god effekt vid administrering en gång per dag.
Mesalazin- och olsalazinpreparat ger inga sulfarelaterade problem men andra biverkningar (allergiska reaktioner, hud-utslag) kan förekomma. Den vanligaste biverkningen för olsa-lazin är lösare avföring, ett problem som dock kan begränsas om preparatet dels successivt titreras upp till full dos och dels alltid tas efter måltid. Interstitiell nefrit har rapporterats vid behandling med alla 5-ASA-baserade läkemedel inklusive sulfazalasin. Andra men ovanliga biverkningar vid 5-ASA-behandling är pankreatit, pleurit, perikardit, dermatit, artrit och även i enstaka fall har kolit beskrivits.
Den terapeutiska effekten av de sulfafria alternativen är i paritet med den för sulfasalazin.
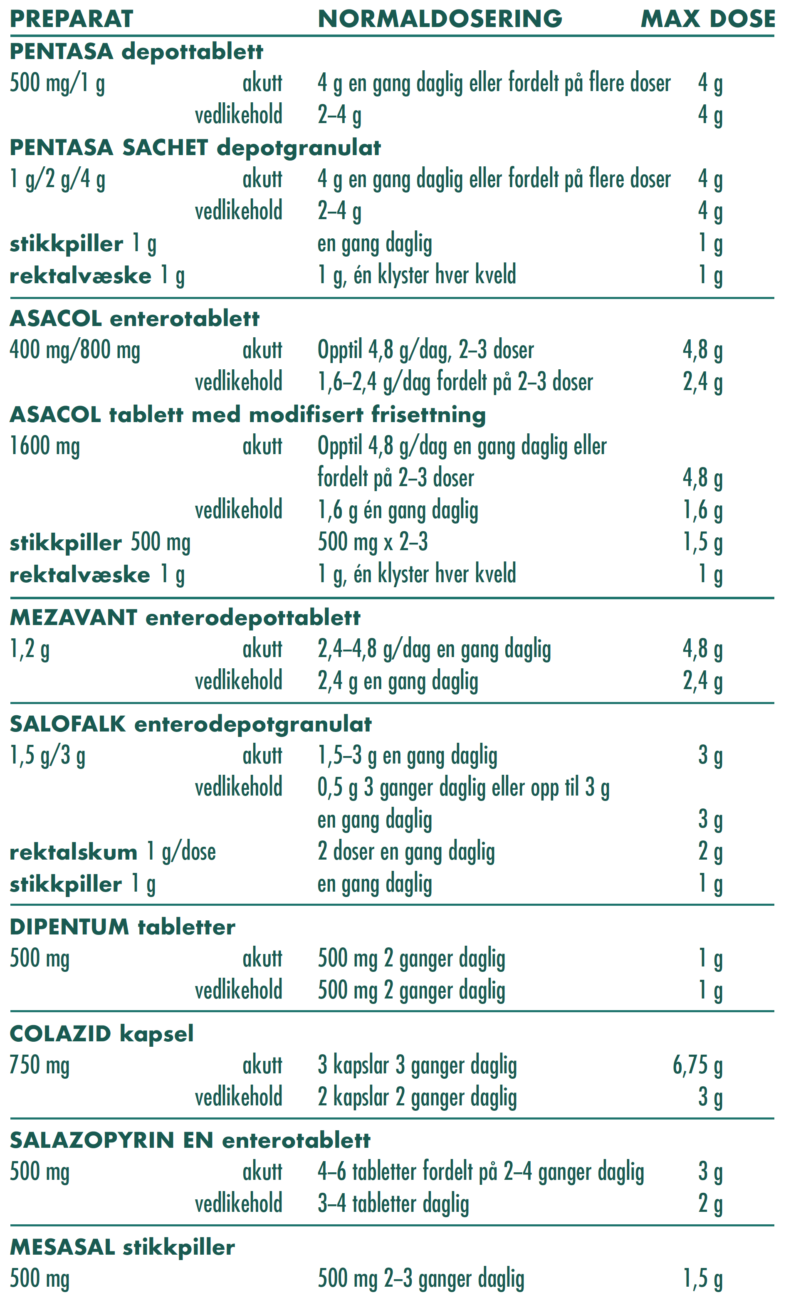
Tabell 16. Salicylatbehandling vid UC
For detaljert informasjon se www.felleskatalogen.no
Rektala applikationer
Topikala, rektala beredningar av 5-ASA d.v.s. rektalsuspension, skum och suppositorier utgör första terapilinjen för akut distal kolit och proktit.
2. Glukokortikoidsteroider
Systemiska GCS (vanligen per oralt prednisolon) ges vid mer utbredd kolit och vid svårare skov och bör övervägas tidigt redan vid milda skov av extensiv eller vänstersidig kolit p.g.a. att det är ett potentiellt farligare tillstånd (risk för utveckling till allvarligare skov). GCS har vanligen en prompt insättande effekt hos ca 70–90 % patienterna. Bästa effekten erhålls på mildare skov av icke extensiv kolit.
Cortiment® (budesonid), d.v.s. per oralt budesonid i en s.k. multimatrix kapsel som levererar den aktiva substansen till hela kolon, utgör ett alternativ till sedvanlig systemisk kortisonbehandling vid mild till måttlig UC. Läkemedlet metaboliseras till 85–90 % i levern, vilket begränsar de systemiska effekterna, och har visat effektivitet framför allt vid vänstersidig kolit som inte svarat adekvat på 5-ASA-behandling. Cortiment® kan även vara ett alternativ när relativ kontraindikation föreligger för sedvanlig system-isk kortisonbehandling, t.ex. vid svårtinställd diabetes eller osteoporos. Hittills har endast studier begränsade till 8 veckor publicerats och doseringen är 9 mg en gång dagligen. Enligt en observationsstudie kan kombinationen 5-ASA och Cortiment ge bättre effekt, men detta har inte kunnat visas i de randomiserade studierna.
3. Immunmodulerande preparat
Generellt bör immunmodulerande behandling vid IBD skötas vid enheter med särskilt intresse och erfarenhet av denna typ av terapi.
Tiopuriner, d.v.s. azatioprin, (Imurel®) och dess metabolit 6-merkaptopurin(6-MP, Puri-Nethol®) är en typ av immun-modulerare som interfererar med de novo syntesen av puriner och därmed produktionen av bl.a. vita blodkroppar.
Azatioprin/6-MP utgör en effektiv underhållsbehandling vid UC. Då tiopuriner kan ha ett fördröjt anslag upp till några månader är det särskilt viktigt vid UC att kombinera med annan behandling under den akuta fasen. Dessa läke-medel utgör således inte akut medicinsk behandling som ska ges för att inducera klinisk remssion. De ska ses som remissionsbevarande, d.v.s. underhållsbehandling.
På många kliniker i Sverige görs idag en fenotypbestäm- ning av enzymet TPMT – TioPurinMetylTransferas före insättning av tiopuriner för att utesluta att patienten saknar enzymaktivitet och även identifiera intermediär aktivitet. De få patienter som saknar eller har kraftigt nedsatt TPMT- aktivitet (ca 1/300) ska ej behandlas med tiopuriner efter- som de då riskerar att drabbas av benmärgsdepression. Vid normal eller intermediär TPMT-aktivitet kan tiopuriner introduceras med successiv dosökning. Vid intermediär TPMT-fenotyp bör måldosen reduceras något.
Normal startdos av azatioprin kan vara 25 mg/dag med upptrappning till en måldos mellan 2 och 2,5 mg/kg med dosupptrappning varje eller varannan vecka. Måldos bör ej nås förrän efter 4 veckors upptitrering för att und-vika illamående och muskelvärk. Kontroll görs av blod- och leverstatus cirka var 10e dag tills patienten uppvisat stabila blodprover under behandling med måldos. Därefter glesas kontrollerna ut till förslagsvis var tredje månad. 6-MP har måldos 1–1,5 mg/kg. Hos steroidberoende patienter kan GCS-dosen minskas successivt när azatioprin börjar verka och i de flesta fall helt utsättas så småningom. Aminosalicylater per os behålls vanligtvis.
Vissa patienter kan behöva en högre azatioprindos än 2 mg/kg för att nå full effekt och man får ofta finjustera dosen med ledning av surrogatmarkörer som LPK (bör ligga runt 4 för optimal effekt) och MCV (bör vara 100 eller högre). De laboratorier som idag analyserar TPMT kan även bestämma huvudmetaboliten 6-tioguanin (6-TGN) och analys av denna kan vara till ytterligare hjälp under pågående behandling för finjustering av dosen. TGN bör ligga mellan 200 och 400. 6-metylmerkaptopurin (6-MMP) bör ej överskrida 5000 för att undvika benmärgsdepression och leverpåverkan. Rutinmässig monitorering av metaboliter saknar evidens men om patienten har den högre måldosen på 2,5 mg/kg azatioprin eller 1,5 mg/kg merkaptopurin (eller högre) bör metaboliter kontrolleras. Detta gäller även om man sätter in normaldos på patienter med lägre TPMT-aktivitet. Risken för allmän intolerans med illamående, muskelvärk, ibland feber eller (oftast mild, bioke-misk) pankreatit är ca 10–15 %. I enstaka fall kan förhöjning av transaminaser ses och är ofta dosberoende.
Vid intolerans mot azatioprin bör istället 6-MP (Puri-nethol®) prövas. Preparatet ska ges i lägre dygnsdos (1–1,5 mg/kg) än azatioprin. Purinethol® tycks i klinisk användning och vid långsamt upptrappad dos ge mindre bekymmer med ospecifika biverkningar som t.ex. illamående. Tioguanin (Lanvis®) är ytterligare en tiopurin som har prövats vid IBD men användningen av detta preparat bör förbehållas specialist-centra med mycket stor erfarenhet av tiopurinterapi p.g.a. risk för leverbiverkningar.
Metotrexat (MTX) har i nuläget ingen evidensbaserad position i behandlingen av UC på grund av brist på kliniska studier. Trots det nämns MTX som ett behandlingsalternativ i de europeiska riktlinjerna även om det inte ingår i svensk behandlingstradition vid UC.
4. Biologisk behandling
Biologiska läkemedel är antikroppar som inhiberar en specifik signal/receptormekanism i den inflammatoriska processen.
Antikroppar mot cytokinen TNF är en etablerad behandling vid måttlig till svår UC. Tre olika IgG-antikroppar finns tillängliga. Infliximab (IFX, Remicade®) är en chimerisk antikropp med en liten del från mus. Antikroppen ges som infusion (5 mg/kg) med en induktionsfas vecka 0, 2 och 6 och därefter underhållsbehandling var åttonde vecka. Adalimumab (Humira®) är en human IgG-antikropp som patienten själv kan injicera subkutant. Induktionsbehandling inleds med 160 mg första veckan, 80 mg efter två veckor, och därefter 40 mg varannan vecka som underhållsbehand-ling. Golimumab (Simponi®) är den senaste anti-TNF-antikroppen och är liksom adalimumab en helt humaniserad IgG-antikropp som injiceras subkutant.
Golimumab har endast UC som indikation (ej CD) och induktionsbehandlingen utgörs av 200 mg vecka 0 och 100 mg vecka 2. Därefter ges underhållsbehandling, 100 mg var fjärde vecka för patienter som väger över 80 kg och 50 mg var fjärde vecka för övriga.
Vid behov kan underhållsbehandlingen behöva intensifi-eras. Ökad dosering upp till 10 mg/kg eller tätare intervall vid IFX-behandling samt 40 mg/vecka avseende adalimumab kan tillgripas vid symptomgenombrott.
Studier talar för att kombinationsbehandlingen azatioprin och infliximab ger bäst effekt bland tidigare tiopurin/anti-TNF-naiva patienter. Delvis kan effekten av kombinations-behandling hänföras en reducerad risk att bilda antikroppar mot läkemedlet.
Biosimilarer, dvs nästan identiska kopior, har introducerats på den svenska marknaden för IFX och adalimumab. För IBD-patienter som ska sättas in på IFX (bionaiva patienter) tyder kliniska studier på att originalpreparat och biosimilarer är likvärdiga. Att byta från originalpreparat till biosimilar är ej heller associerad med behandlingssvikt eller intolerans enligt den stora norska studien NOR-Switch, där IFX byttes till biosimilaren CTP-13. Biosimilarer kan dock inte jämföras med generiska läkemedel som är fritt utbytbara. Det finns en teoretisk risk för minskad effekt vid multipla byten.
IFX (inkl IFX-biosimilarer) intar en central position vid akut kolit eftersom en IFX-infusion kan användas för så kal-lad rescue-behandling vid GCS-refraktär kolit med hotande kolektomi (se nedan).
Ytterligare ett biologiskt läkemedel med en helt annan verkningsmekanism har introducerats för såväl UC som CD, vedolizumab (Entyvio®), en monoklonal IgG-antikropp som blockerar integrinen a4b7 på cirkulerande immun-celler. Denna integrin uttrycks bland annat på T-celler och monocyter och möjliggör att dessa immunceller kan fästa vid MAdCAM-1 uttryckt på endotelet i tarmväggens blodkärl. Tack vare denna ”homing-mekanism” hittar immunceller till tarmen och rekrytering av aktiverade T-celler och mono-cyter från blodet är troligen avgörande för en fortsatt inflammatorisk aktivitet. Genom att blockera integrinen förhindras immuncellerna att migrera över till slemhinnan och underhålla inflammationen. Samlingsnamnet för denna typ av biologiskt läkemedel är integrinhämmare. Entyvio® ges intravenöst med en fast dos (300 mg) med samma intervall som Remicade®, d.v.s. vecka 0, 2, 6 och därefter var åttonde vecka. Patienten genomgår samma screening före Entyvio®-behandling som vid Remicade®. På grund av att läkemed-lets effekt baseras på minskad rekryteringen av aktiverade immunceller till tarmen får man räkna med en långsammare respons jämfört med anti-TNF. Det fördröjda behandlings-svaret är dock tydligare vid CD jämfört med UC. Troligen är integrinhämning mer tarmspecifik än anti-TNF-inhibition eftersom a4b7 uttrycks relativt specifikt i tarmväggen och den systemiska immunsuppressionen är begränsad. Vid partiell respons finns möjligheten att täta doseringsintervallen ner till var 6–4e vecka.
Det senaste alternativet bland biologiska läkemedel är uste-kinumab (Stelara®) för UC. Stelara är en IgG-antikropp mot p40 subenheten som återfinns både på interleukin 12 (IL-12) och interleukin 23 (IL-23), varför bägge cytokinerna block-eras. Cirka 6 mg/kg ges intravenöst som startdos följt av en andra dos 90 mg subkutant efter 8 veckor. Om patienten svarar på behandlingen ges fortsättningsvis subkutana injek-tioner var 12:e vecka.
Om patienten inte svarat adekvat på behandlingen 8 veckor efter första subkutana dosen kan den andra subkutana dosen ges redan efter 8 veckor. Vid partiellt svar finns möj-ligheten att fortsätta med 90 mg subkutant var åttonde vecka. Ustekinumabs position i behandlingsstrategin är inte klarlagd i kliniska studier.
5. Jak-hämmare
Jak-hämmare inhiberar intracellulära Januskinaser (JAK) i immunceller. JAK vidarekopplar signalen när cytokiner fäster på cytokinreceptorer på cellytan. Signalen skickas vidare från receptorn via JAK till cellkärnan, där olika gener aktiveras eller inhiberas. I jämförelse med biologisk behandling som ofta neutraliserar en cytokin, blockerar Jak-hämmare signaler från flera cytokiner och har därmed ett bredare immunsuppri-merande anslag. Jak-hämmare är små molekyler som tas per os. Den första Jak-hämmaren som är godkänd för måttlig till svår ulcerös kolit är tofacitinib (Xeljanz®), som blockerar flera cytokiner (bl a IL-2, IL-6, IFN-g) via JAK 1-(2)-3. Tofacitinib tabletter 10mg x 2 ges de första 8 veckorna som induktionsbe-handling och därefter 5mg x 2 som underhållsbehandling. Om patienten inte svarar tillräckligt under de 8 första veckorna kan man fortsätta med den högre dosen i ytterligare 8 veckor för att därefter sänka dosen till underhållsbehandling. Man bör inte fortsätta mer än 16 veckor vid uteblivet svar. Om patienten tidigare inte svarat på anti-TNF eller om behandlingssvikt inträder finns möjligheten att doseskalera till 10mg x 2 som underhållsbehandling. Samma screening ska genomföras som vid biologisk behandling, d.v.s. tuberkulos, hepatit B/C och varicella. Man bör även kontrollera blodstatus inkl B-diff eftersom tofacitinib ej bör insättas hos patienter med ett absolut lymfocyttal ≤ 0,75 x 109/l, neutrofiltal ≤ 1,0 x 109/l eller Hb < 90g/l. Anemi, infektioner och förhöjda blodfet-ter är några av de biverkningar som rapporterats i studierna. Hb, lymfocyter och neutrofiler bör monitoreras före, efter 4–8 veckor och därefter var tredje månad. Lipidvärden bör kontrolleras 8 veckor efter insättning och statiner har effekt på höga lipidnivåer. Vid infektion pausas behandlingen och kan återinsättas med bibehållen effekt efter läkning. Efterföljande studier har även visat ökad risk för tromboskomplikationer hos vissa patientgrupper, varför riskfaktorer för trombossjukdom bör penetreras innan insättning av tofacitinib. Tofacitinib kan användas direkt efter otillräcklig effekt av konventionell behandling (5-ASA, GCS och tiopuriner) eller vid behand-lingssvikt med biologiska läkemedel. Jak-hämmare ska inte kombineras med tiopuriner eller biologiska läkemedel. Studier har visat att tofacitinib kan ge relativt snabb symptomlindring. Jak-hämmares positionering i behandlingsstrategin behöver dock utvärderas ytterligare.
Innan biologisk behandling eller Jak-inhibering initieras ska patienten screenas för tuberkulos.
Behandlingssituationer vid UC
Extensiv kolit
1. Lätt skov
A. 5-ASA eller sulfasalazin peroralt (doser, se Tabell 16).
B. Tillägg med antingen prednisolon eller 5-ASA i rektal-suspension till natten. Cortiment® kan vara ett alternativ.
C. Överväg peroralt prednisolon om utbredning proximalt om vänster flexur (prednisolon 20–40 mg/dygn med successiv nedtrappning över 4–8 veckor).
D. Överväg immunmodulering med azatioprin/6-MP,
ev biologisk behandling om bristfälligt svar på ovanstående. Även Jak-hämmare kan övervägas om tiopuriner/biologisk behandling ej har tillräcklig effekt.
2. Medelsvårt skov
A. Insätt peroralt prednisolon tidigt (prednisolon 40–60 mg/dygn i successiv nedtrappning beroende på svar med 6–12 veckors behandlingstid).
B. Sätt in 5-ASA eller sulfasalazin (eller öka dosen).
C. Lägg till rektalsuspension (1–2 ggr per dag).
D. Överväg behandling med anti-TNF. Integrinhämmare eller anti-IL-12/23 kan övervägas. Jak-hämmare kan även övervägas.
E. Om inte övertygande svar erhållits inom 3–7 dagar bör patienten läggas in för ställningstagande till i.v. GCS och/eller annan intensifierad behandling.
3. Svårt skov
Svåra akuta koliter måste identifieras tidigt i förloppet och de är alltid fall för sluten vård med intensiv övervakning och gemensam bedömning av medicinsk gastroenterolog och kolorektalkirurg. Beredskap för akut kirurgi om patienten inte förbättrats inom 5–7 dagar (den s.k. Oxfordregeln). Det allvarliga medicinska läget vid akut svår kolit underskattas lätt eftersom patienten kan vara bedrägligt opåverkad med mjuk och oöm buk vid palpering.
A. GCS i.v. i fulldos betametason (Betapred®) 4–8 mg x 2. Ge även 5-ASA eller GCS rektalt om det bedöms lämpligt.
B. Vätska + elektrolyter intravenöst för att ersätta förluster. Vid uttalad anemi: Överväg transfusion med erytrocytkoncentrat.
C. Total parenteral nutrition (TPN) har ej visat sig vara av ytterligare nytta till redan given GCS-behandling, men ges vanligen vid ett svårt skov för att optimera patientens nutritionsstatus inför eventuell kolektomi. Undvik CVK om möjligt så att risken för katetersepsis minskas. Byte av perifer nål varje till vartannat dygn bör försökas i första hand.
D. Avföringsodling och fecesanalys med avseende på cystor och maskägg samt Cl. Difficile cytotoxin B bör alltid göras för att utesluta en infektiös komponent i det aktuella skovet, även hos kända UC-fall. Även CMV-infektion måste övervägas. I sällsynta fall kan även EHEC-infektion ge en akut kolitbild. Vid misstanke om samtidig infektion (t.ex. Campylobacter, Salmonella, Shigella) bör antibiotikabehandling övervägas tidigt. Kinoloner, typ ciprofloxacin är förstahandsalternativ. Finns misstanke om perforation insätt omedelbart antibiotika (t.ex. metronidazol + cefotaxim intravenöst).
E. Om patienten ej har illamående eller kräkningar:
- Öka tidigare sulfasalazin- eller 5-ASA-dos.
- Insätt 5-ASA. (Var uppmärksam på eventuell sulfaöverkänslighet.)
F. Överväg Fragmin® i profylaktisk dos för att förebygga tromoemboliska komplikationer vid svår kolit (framför allt vid UC men även vid CD).
Övervakningsschema vid svårt skov
Status
(Minst två gånger per dygn, tätare vid allvarligare skov.)
- Allmäntillstånd.
- Bukstatus
- Temperatur.
- Puls/Blodtryck.
Provtagning
- De första 3 dygnen daglig kontroll av Hb, CRP, Albumin, LPK, TPK samt elektrolyter (tas därefter varannan dag om förbättring sker).
Obs! Tänk på att GCS-behandling ofta inducerar
LPK-stegring samtidigt som GCS även kan maskera
septiska komplikationer, t. ex. tarmperforation.
Röntgen
Buköversikt (BÖS) utföres direkt vid inkomsten. Därefter dagligen eller glesare beroende på terapeutiskt svar. Ny BÖS görs om försämring i symptombilden eller vid stigande CRP eller annan inflammationsmarkör. Vid misstanke om abscess görs akut ultraljud eller DT.
Kvarstående subfebrilitet, CRP-stegring eller frekventa blodiga diarréer dag 3 är prognostiskt ogynnsamt.9
Kolondilatation vid röntgen är ett mycket allvarligt prognostiskt tecken och måste föranleda ställningstagande till kolektomi. Vid konstaterad kolondilatation på röntgen bör man undvika endoskopi p.g.a. risken för perforation.
Behandlingssvar/förlopp
Vanligen svarar ca 50 % prompt på 3–4 dagars behandling enligt A-C, ytterligare 10–20 % har ett långsammare svar.
Vid bristfällig eller ingen respons dag 3: Överväg behand-ling med infliximab (5 mg/kg kroppsvikt efter att latent TBC uteslutits – se kapitel om CD, sidan 66). Så kallade ”Sverige”-index, dvs antal tarmtömningar/dygn + (0,14 x CRP), kan utgöra beslutsstöd avseende akut behandling med infliximab. Om värdet är >8 föreligger en 70 % risk för kolektomi inom 30 dagar och indikation för rescuebehand-ling stärks. Vid <8 är risken 16 %. Om patienten svarar på infliximab med sjunkande avföringsfrekvens, mindre blod och förbättrat AT: IFX-behandlingen bör då fortsätta och insättning av azatioprin bör övervägas (se sidan 65 under CD).
Om försämrat bukstatus, stigande temperatur, stigande eller kvarstående CRP och/eller röntgenverifierad kolondi-latation under adekvat behandling ska alltid akut kolektomi övervägas. I denna situation är det viktigt med gemensam bedömning av kirurg och medicinsk gastroenterolog.
Distal kolit
5-ASA ges i första hand som lokalbehandling (rektalsus-pension, skum eller suppositorium 1–2 gånger/dag, se Tabell 16) vid proktit eller maximalt vänstersidig kolit. Lokalbehandling med rektala 5-ASA-preparat bör bibehållas 4–8 veckor och fortsätta även efter klinisk förbättring för att sedan gradvis trappas ned till en acceptabel underhållsdos för patienten, eventuellt skiftas ut mot ett oralt preparat. Vid terapisvikt med rektala 5-ASA-preparat kan istället byte till en topikal GCS-beredning prövas: (rektalsuspension eller skum) med Prednisolon Klysma (f.d. Pred-Clysma®), hydro-kortison (Colifoam®) eller budesonid skum (Budenofalk®). Vid refraktär distal kolit (d.v.s. ingen terapeutisk effekt trots 4–8 veckors behandling) byter man i första hand till det som ej prövats, alternativt kombinerar behandlingsalterna-tiven ovan.
Immunomodulerande behandling med azatioprin över-vägs tidigt och biologisk behandling kan ibland bli nödvän-digt. Endast i de svåratse fallen av distal kolit blir slutenvård med högdos av orala eller i.v. GCS aktuellt och operation behöver sällan tillgripas.
Alternativa behandlingar vid distal kolit
Lokalanalgetika (Gel Xylocain® (lidokain), 2 % steril endosspruta 10 g, 1 x 2–4) är en atoxisk empiriskt utprövad alternativ-behandling som kan ha god effekt på tenesmer.
S.k. leukocytaferes är en alternativ, icke farmakologisk, behandlingsform som utvecklats i Japan. I korthet går metoden ut på att patientens blod leds genom ett filter och vissa aktiverade leukocyter avskiljs. Behandlingen kan behöva upprepas 5–10 ggr under en 5–8 veckors period. Metoden är skonsam och behäftad med få biverkningar. AdaColumn® finns tillgänglig i Sverige. Aferesbehandling kan ha effekt i paritet med kortison för vissa patienter. För närvarande är rollen för aferes oklar enligt en SBU-rapport från 2009 och två stora RCT-studier på CD och UC har inte visat signifikant klinisk effekt.
Underhållsbehandling
UC/proktit har en hög recidivfrekvens efter att remis-sion väl uppnåtts med akutbehandling (>70 % inom ett år). Återfallsrisken kan dock minskas till ca 20 % per år med underhållsbehandling. Långtidsbehandling med 5- ASA har visat sig signifikant minska återfallsrisken. Underhållsbehandling bör erbjudas patienterna oavsett utbredning och är i princip att betrakta som livslång. För dosering se Tabell 16. Njurfunktionern bör kontrolleras två gånger årligen vid underhållsbehandling med 5-ASA.
ASA i suppositorieform kan användas som remissions- bevarande behandling givet varannan till var tredje dag vid proktit. Patienter som sviktar på ovanstående regimer kan erbjudas kombinationsbehandling med både oral och rektal underhållsterapi, vilken dock ofta är behäftad med brist-fällig följsamhet.
GCS har ingen visad remissionsbevarande potential i lägre doser. Vid steroidberoende UC där operation ej är ett rimligt alternativ bör alltid azatioprin/6-MP försöka sät-tas in. Metotrexat används traditionellt inte i Sverige som underhållsbehandling vid UC. Behandling med biologiska läkemedel har visat remissionsbevarande effekt vid UC och är indicerat då patienten inte svarar adekvat på konven-tionell behandling med 5-ASA och tiopuriner. Samtliga anti-TNF-antikroppar har indikationen UC. Även integrin-hämmaren vedolizumab och anti-IL-12/23-antikroppen ustekinumab utgör ett alternativ vid underhållsbehandling då konventionell behandling ej är tillfyllest. Jak-hämmare är även ett alternativ vid underhållsbehandling av UC.
Medicinsk behandling av CD
1. 5-Aminosalicylat (5-ASA)
Inget rent 5-ASA-preparat finns registrerat för indikationen CD i Sverige, utan än så länge är det endast det med sulfa- pyridin sammansatta klassiska sulfasalazinet (SASP), med en modest effekt vid ileokolisk och kolorektal CD, som har denna indikation. I Norge er Pentasa og Asacol godkjent for CD. De europeiska riktlinjerna stöder inte att 5-ASA används för CD. Dock finns viss evidens för 5-ASA som profylax-behandling mot recidiv efter ileocekal resektion.
2. Glukokortikosteroider (GCS)
GCS är den effektivaste medicinska behandlingen vid akuta skov av CD. Ungefär 60–80 % av patienterna uppnår kli- nisk (symptomatisk) remission vid behandling med peroralt prednisolon. Det är dock skillnad på kliniskt och endosko-piskt svar. Vid en standardbehandling med prednisolon ses ibland endast en begränsad förbättring av den endosko-piska bilden. Endast en knapp tredjedel av CD-patienterna verkar nå fullständig slemhinneläkning vid högdos kortison-behandling (1 mg/kg).
Normal startdos prednisolon 40–60 mg/dag, eventuellt uppdelat på två doser initialt, men med successiv nedtrapp- ning och senare övergång till enbart morgondosering. Högre dos ger sällan bättre kliniskt svar. Ett tydligt terapeutiskt svar brukar ses inom 2 veckor och prednisolondosen kan därefter minskas med ca 5–10 mg var 7–14:e dag. Långsammare nedtrappning rekommenderas i slutet av kuren, som vanligen kan avslutas inom 2–3 månader.
Ca 20–40 % av patienterna svarar dock bristfälligt eller inte alls på GCS och även efter framgångsrik behandling är återfall mycket vanligt (ca 70 % inom ett år om patienten inte får underhållsbehandling). Risken för GCS-associerade biverkningar (akne, ansiktssvullnad, viktuppgång, nedsatt glukostolerans, risk för blåmärken m.m.) är ca 60 % med sedvanlig prednisolonbehandling vid ileocekal CD. Det finns vidare en risk (om än låg) för septiska komplikationer hos patienter med en palpabel resistens i buken vid använd- ande av systemiska GCS. Vid långtidsbehandling finns dessutom en uppenbar risk för andra mer allvarliga och ibland irreversibla komplikationer såsom osteonekros, osteo- poros, katarakt och manifest diabetes mellitus. Systemisk GCS som prednisolon är därför inte ett alternativ för under- hållsbehandling med undantaget budesonid.
Budesonid (Entocort®, Budenofalk®) är en topikalt ver-kande högpotent GCS-beredning med låg systemisk till-gänglighet. I en dos på 9 mg/dygn är budesonid likvärdig med prednisolon avseende induktion av symptomatisk remission, men har en beskedligare biverkningsprofil (hälf-ten så många och även mindre svåra biverkningar). Ungefär 90 % av budesonid genomgår första-passage-metabolism i levern vilket innebär att endast ca 10 % ger systemisk belastning. Budesonid har betydligt högre receptoraffinitet än prednisolon men det är svårt att jämföra den kortikoida effekten mellan preparaten. Ovanstående beredningar av budesonid är optimerade för CD lokaliserad i terminala ileum och/eller högerkolon.
3. Immunmodulerande preparat
Tiopuriner (azatioprin och dess metabolit 6-MP) har visat sig effektiva framför allt vid steroidberoende eller vid steroid-refraktär sjukdom. Indikation för insättning föreligger även vid tidiga recidiv och/eller vid mer extensiv tunntarms-sjukdom när kirurgisk behandling av olika skäl inte är ett huvudalternativ samt vid kolon-Crohn +/- samtidig fistel-sjukdom. Preparatet insättes vanligen i samband med en GCS-kur eftersom tiden till optimal behandlingseffekt kan dröja upp till 3–6 månader. Insättningen sker på samma sätt som vid UC (se sid 50) med fenotypbestämning av enzymet TPMT – TioPurinMetylTransferas före insättning eftersom de få patienter som saknar eller har kraftigt nedsatt TPMT- aktivitet ej ska behandlas med tiopuriner.
Normal startdos av azatioprin kan vara 25 mg/dag med upptrappning till en måldos mellan 2 och 2,5 mg/kg; 6-MP har måldos 1–1,5 mg/kg. Hos steroidberoende patienter kan GCS-dosen minskas successivt när azatioprin börjar verka och i de flesta fall helt utsättas så småningom.
I likhet med UC kan vissa patienter kan behöva en högre azatioprindos än 2 mg/ kg för att nå full effekt och man får ofta finjustera dosen med ledning av LPK (bör ligga runt 4 för optimal effekt) och MCV (bör vara 100 eller högre). Analys av metaboliten 6-TGN (ca 200–400) kan vara till ytterligare hjälp under pågående behandling för finjustering av dosen. Som vid UC bör 6-MMP ej överskrida 5000 för att undvika benmärgsdepression och leverpåverkan. Se UC-avsnittet för ytterligare beskrivning av tiopurinbehandling.
Andra immunmodulerare som kan övervägas vid kronisk aktiv kortisonberoende CD innefattar främst metotrexat givet subkutant/intramuskulärt i låg dos (25 mg som induktion en gång i veckan i ca 12 veckor). Folsyra ska substitueras vid MTX-behandling och ges enligt praxis dagen efter samt tva dagar efter injektionsdagen. MTX har prövats med framgång hos steroidberoende patienter i kon-trollerade studier och kan vara ett tredjehandsalternativ vid intolerans mot azatioprin eller 6-MP. Levertoxicitet är ett potentiellt bekymmer vid långtidsbehandling och en i övrigt hög biverkningsfrekvens ger problem med tolerabilitet. Även njurpåverkan kan ses och kreatinin ska följas. Peroral MTX-behandling tycks ej fungera väl vid CD p.g.a. stor variabi-litet i upptag. Om patienten svarar adekvat på MTX, sänks dosen efter cirka tre månaders induktionsbehandling till 15 mg injektion en gång i veckan. Fibrosutveckling framförallt i lever men även i lungor är en allvarlig men sällsynt biverkan.
4. Biologisk terapi
Biologiska läkemedel är som tidigare nämnt antikroppar som inhiberar en specifik signal/receptormekanism i den inflammatoriska processer. Antikroppar mot cytokinen TNF är en etablerad behandling vid måttlig till svår CD, inklusive fistlar. Två olika IgG-antikroppar finns tillängliga med indikationen CD. Infliximab (IFX, Remicade®), den chimeriska antikroppen med en liten del från mus som ges i.v. (5 mg/kg) med en induktionsfas vecka 0, 2 och 8 och därefter underhållsbehandling var åttonde vecka. Adalimumab (Humira®) är en human IgG-antikropp som patienten injicerar subkutant. Liksom vid UC inleds induk-tionsbehandling med 160 mg första veckan, 80 mg efter två veckor, och därefter 40 mg varannan vecka som underhålls-behandling. Doseskalering sker på samma sätt som vid UC (se sid 53). Anti-TNF-behandling ger symptomatisk remis-sion i upp till 40 % efter 4 veckor och upp till cirka 70 % erhål-ler signifikant symptomreduktion. Upp till 50 % av aktiva fistlar sluts efter en behandlingsomgång med tre infusioner av IFX (0, 2 samt 6 veckor). Symptom och endoskopisk/his-tologisk bild förbättras i de flesta fall under behandling. Efter introduktionen av biologisk terapi har behandlingsmålen vid inflammatorisk tarmsjukdom skärpts och man bör om möj-ligt eftersträva såväl endoskopisk som histologisk remission, s.k. djup remission (se tabell 15). Allmänt välbefinnande, hälsorelaterad livskvalitet samt kronisk trötthet påverkas oftast i positiv riktning. Liksom vid UC ger kombinations-behandlingen azatioprin och infliximab bäst effekt bland tidigare tiopurin/anti-TNF-naiva patienter (resultaten base-ras på en 50 veckor lång CD-studie, Sonic). Biosimilarer har introducerats de senaste åren (se UC-avsnitt sid 53).
Som nämns i UC-avsnittet är ytterligare en monoklonal IgG-antikropp tillgänglig som blockerar receptorn a4b7 på cirkulerande immunceller, vedolizumab (Entyvio®). Genom att inhibera denna integrin förhindras immunceller att migrera över till slemhinnan och underhålla tarminflamma-tionen. Entyvio® ges intravenöst med en fast dos (300 mg) med samma intervall som Remicade®, d.v.s. vecka noll, två, sex och därefter var åttonde vecka. Vid CD finns möjlighet att ge en extrados vecka tio för att förlänga induktionen vid otillräcklig klinisk effekt. Patienten genomgår samma screen-ing före vedolizumab-behandling som vid infliximab. På grund av att läkemedlet minskar rekryteringen av aktiverade immunceller till tarmen får man räkna med ett långsamt svar, cirka tre till sex månader vid CD till full effekt kan förväntas. Samlingsnamnet för denna typ av biologiskt läke-medel är integrinhämmare. Troligen är integrinhämning mer tarmspecifik än anti-TNF-inhibition eftersom a4b7 uttrycks relativt specifikt i tarmväggen. Liksom vid UC kan man täta intervallet ner till var 6–4e vecka vid otillräcklig behandlingseffekt.
Det senaste alternativet bland biologiska läkemedel är ustekinumab (Stelara®). Ustekinumab är en IgG-antikropp mot p40 subenheten som delas av IL-12 och IL-23, varför bägge cytokinerna blockeras. Cirka 6 mg/kg ges intra-venöst som startdos följt av en andra dos 90 mg subkutant efter 8 veckor. Om patienten svarar på behandlingen ges fortsättningsvis subkutana injektioner var 12:e vecka. Om patienten inte svarat adekvat på behandlingen 8 veckor efter första subkutana dosen kan den andra subkutana dosen ges redan efter 8 veckor. Vid otillräckligt svar finns möjlighe-ten att fortsätta med 90 mg subkutant var åttonde vecka.
Ustekinumabs position i behandlingsstrategin är inte klar-lagd i kliniska studier. Värdet av kombinationsbehandling med tiopuriner vid vedolizumab eller ustekinumabbehand-ling har inte kunnat visas i hittills publicerade stora studier.
5. Antibiotika
Metronidazol (Flagyl®), som är verksamt mot protozoer och anaeroba bakterier har effekt t.ex. i fall av bakteriell överväxt som ofta förekommer proximalt om stenoser. Läkemedlet har även ofullständigt kartlagda immunmodulerande egen- skaper. Metronidazol har en viss dokumenterad effekt vid lätt till måttlig akut ileocekal CD utan stenosering och är jämförbart med sulfasalazin vid utbredning i kolon. Preparatet har även en viss effekt på fistlar och används som tilläggsbehandling efter kirurgiskt dränage av abscesser, ofta i kombination med t.ex. ciprofloxacin. Dosen av met-ronidazol bör ej överstiga 400 mg x 2 vid längre behandling för att undvika risk för (reversibel) neuropati. Vanliga men oftast tolerabla biverkningar av metronidazol är lätt illamå-ende, metallsmak i munnen och beläggningar på tungan. Preparatet har även en viss antabusliknande effekt vilket patienten bör upplysas om.
Oralt givet ciprofloxacin (Ciproxin®) har i mindre pröv- ningar visat sig ha en behandlingseffekt i paritet med prednisolon i standarddos. Ciprofloxacin ges lämpligen i dosen 500 mg x 2 under 3–4 veckor. Metronidazol och ciprofloxacin behöver ibland kombineras, men försiktighet bör generellt iakttagas vid förskrivning av dessa antibiotika med tanke på risk för resistensutveckling.
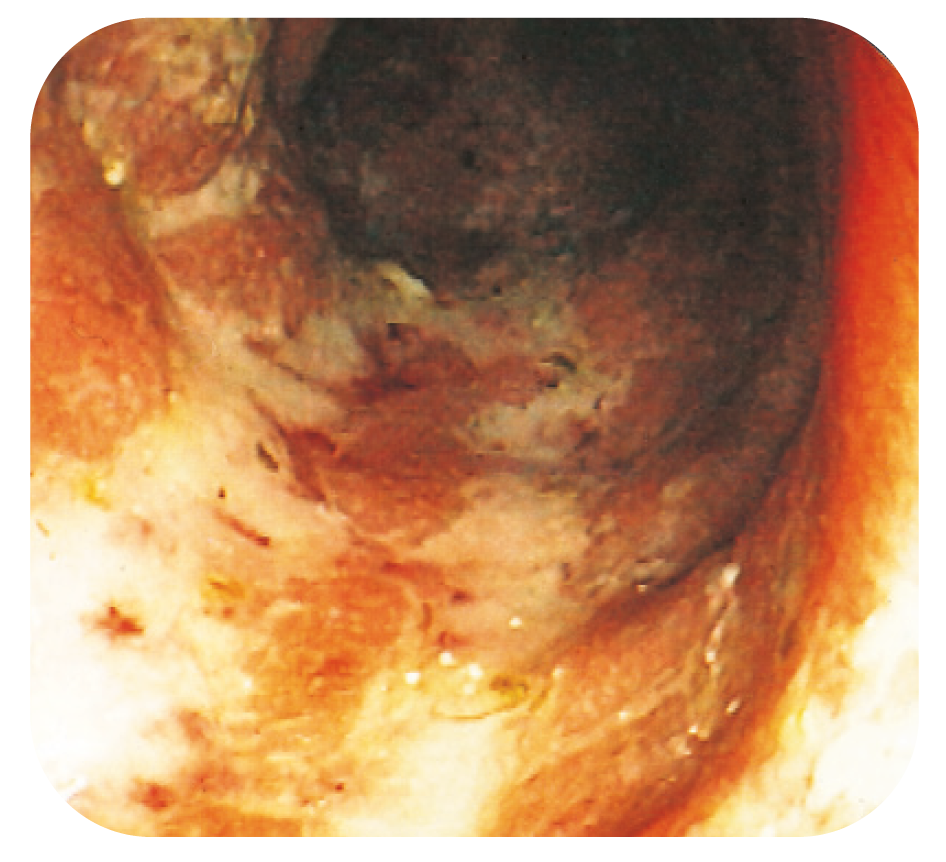
Bild 12.
Longitudinellt arrangerade fibrinbelagda ulcerationer vid kolon-CD.
Svårt skov av Crohn-kolit
Slutenvård med GCS i högdos (prednisolon 60 mg/dygn) peroralt eller betametason (Betapred®) 4–8 mg x 2 intra- venöst har överlägset bäst effekt vid behandling av ett svårt skov av Crohn-kolit. Samtidig behandling med total parenteral nutrition (TPN) och initial tarmvila används ibland. Snar övergång till per os intag av näringsämnen bör eftersträvas, initialt med flytande föda. Patienten bör i övrigt skötas i slutenvården som vid ett svårt skov av UC (se vidare sidan 57).
Underhållsbehandling
Efter ovan beskrivna behandling av det akuta skovet krävs vanligen underhållsbehandling för att undvika recidiv. Flera olika preparat används i remissionsbevarande syfte vid CD:
- Tiopuriner av typ azatioprin/6-MP är sannolikt den pre-parattyp som idag används i störst utsträckning i Sverige. Indikasjon er kombinasjonsbehandling med TNFalfa hem-mare för at förhindra antikroppar. Dernest hvor det innträf-far tilbakefall vid steroinedtrapning for å bibeholde remis-jon. Alternativet er at behandla med TNFalfa hemmare eller andre biologiska läkemedel.
- Långtidsbehandling med biologiska läkemedel (anti-TNF, anti-IL-12/23 eller integrinhämmare) är ofta nöd-vändig hos den andel av patienterna som initialt svarat på dessa preparat, annars kan inflammationen återaktiveras. Även med regelbundet givna infusioner finns risken att effekten avtar över tid, så kallad ”loss of response”. Efter ett år har t. ex. ca 20 % av infliximab-behandlade patienter med initialt god respons recidiverat trots regelbunden under-hållsbehandling var åttonde vecka. Patienter som sviktar kan behöva ökad dos (upp till 10 mg/kg IFX) och/eller kor-tare intervall mellan infusionerna. Även integrinhämmare kan tätas i dosintervall ner till var 4e vecka vid sviktande respons. Även ustekinumab (anti-IL-12/23) kan ges med tätare intervall än var 12e vecka vid behov.
Ibland kan behandling med infliximab vara en över-bryggning till dess att t. ex. azatioprin/6-MP-terapi hunnit få optimal verkan. Man har diskuterat alternativet att ge s.k. top-down-behandling, d. v. s. insättning av anti-TNF-antikroppar tidigt i förloppet och sedan växla ner till monoterapi med immunosuppression när patienten gått i remission. Dock ser man att efter två år är resultaten lik-värdiga mellan step-up och top-down. Man talar nu även om s.k. accelererad step-up, d. v. s. att man raskt går vidare i behandlingstrappan om patienten inte svarar på given behandling, se Figur 4. - Peroral sulfasalazin eller 5-ASA har i vissa studier visat sig minska recidivrisken men resultaten är inte entydiga och även vid denna indikation råder oklarhet beträffande den optimala dosen. Troligen är en hög daglig dos (3–4 g) nödvändig för att erhålla effekt. En del patienter kan ha nytta av underhålls-behandling och risken för långtidsbiverkningar är låg, men behandlingen stöds inte av de europeiska riktlinjerna.
- Metronidazol används ibland som långtidsbehandling (särskilt för patienter med kolorektalt engagemang) men är ej dokumenterat på denna indikation. Vissa patienter använder preparatet vid behov och vidmakthåller på så sätt god symptomkontroll. Dosering kan variera från 200 mg x 1 upp till 400 mg x 2 per dag. Dosen bör ej överstiga 800 mg/dygn p. g. a. risk för dosberoende biverkningar, framför allt neuropatiska.
- Peroralt budesonid har en dokumenterad förmåga att förlänga remissionstiden med ca 3 månader i en dos på 6 mg/dygn bland patienter med ileocolisk CD som nyligen bringats i remission efter kortisonterapi. Den kliniska erfar- enheten av budesonidterapi visar att patienterna kan pendla mellan 9 och 3 mg över längre tidsperioder med låg risk för allvarliga biverkningar. Dock är evidensen för den kliniska effektiviteten svag. Jämfört med kontrollgrupp har man inte kunnat visa någon signifikant vinst med budesonid som underhållsbehandling.
Diarrébehandling vid CD
Kolestyramin (Questran®) givet i upptitrerad dos, 1/4–1 pulver ca 15–30 min före måltid 1–3 gånger dagligen, samt eventuellt till natten, är förstahandsmedel vid diarrébesvär status post ileocekal resektion. Vid nedsatt fördragsamhet kan istället kolestipol i tablettform eller pulver (Lestid® 1 g 1–4 x 2–3) prövas. Cholestagel är ytterligare ett tillgäng-ligt preparat. Andrahandsmedel är loperamid (Imodium®/Dimor®) och i svårare fall kodein (företrädesvis till nat-ten). Ibland kan bulkmedel vara av nytta (t. ex. Inolaxol®, ViSiblin® eller Lunelax®). Vid kort tarm (>1 m borttaget) kan även fettmalabsorption ge diarréer och pankreasenzym till varje måltid kan vara till hjälp (högst individualiserad dosering, börja med 25000 E Creon, 1–2 tabletter vid fru-kost, lunch om middag). Vid mycket uttalade diarrébesvär efter omfattande tarmresektioner kan en somatostatinana-log (Sandostatin®) som subkutan injektion behöva tillgripas, ofta med snabb effekt.
Riskminimering och strategier vid immun- supprimerande behandling
Riskminimering
Tiopuriner och biologiska läkemedel innebär att immunför-svaret försvagas i varierande grad. Detta innebär att risken för infektioner, inklusive opportunistiska agens, måste vär-deras mot nyttan av behandlingen, framför allt hos multi- sjuka eller äldre. Aktiv eller latent TBC måste uteslutas innan biologisk behandling eller Jak-hämmare påbörjas (TB-anamnes, lungröntgen samt PPD eller Quantiferon). Det finns även en liten men signifikant ökad risk att utveckla framför allt lymfom vid immunsuppressiv behand-ling. Även hepatitserologi bör tas innan immunsuppression då reaktivering av hepatit B- och C-virus har beskrivits vid tiopurin- och anti-TNF-behandling. Inför framför allt tiopurininsättning bör man fråga patienten om genom-gången varicellainfektion som barn. Om patienten är osä-ker bör serologi tas eftersom primär varicellainfektion vid immunsuppressiv behandling kan vara livshotande. På sena-re tid har även risken för lymfom vid primär EBV-infektion under tiopurinbehandling uppmärksammats. Därför kan det vara av värde att ta EBV-status inför tiopurininsättning. EBV-negativitet är ingen absolut kontraindikation men bör sammanvägas med övriga risker vid behandlingsbeslut avseende tiopuriner. Det är av vikt att kvinnor följer sedvanliga kontroller för cervix-dysplasier, då det finns studier som pekar på att immunsupprimering kan påskynda dysplasiprocesser. Detsamma gäller vid andra former av cellförändringar/maligniteter i sjukhistorien.
En något ökad risk för hudcancer har observerats vid immunsuppression (framför allt icke-melanomcancer vid tiopurinbehandling). Därför bör patienten informeras om försiktighet vid solexponering samt regelbundna hudkon- troller under behandling med AZA/6-MP.
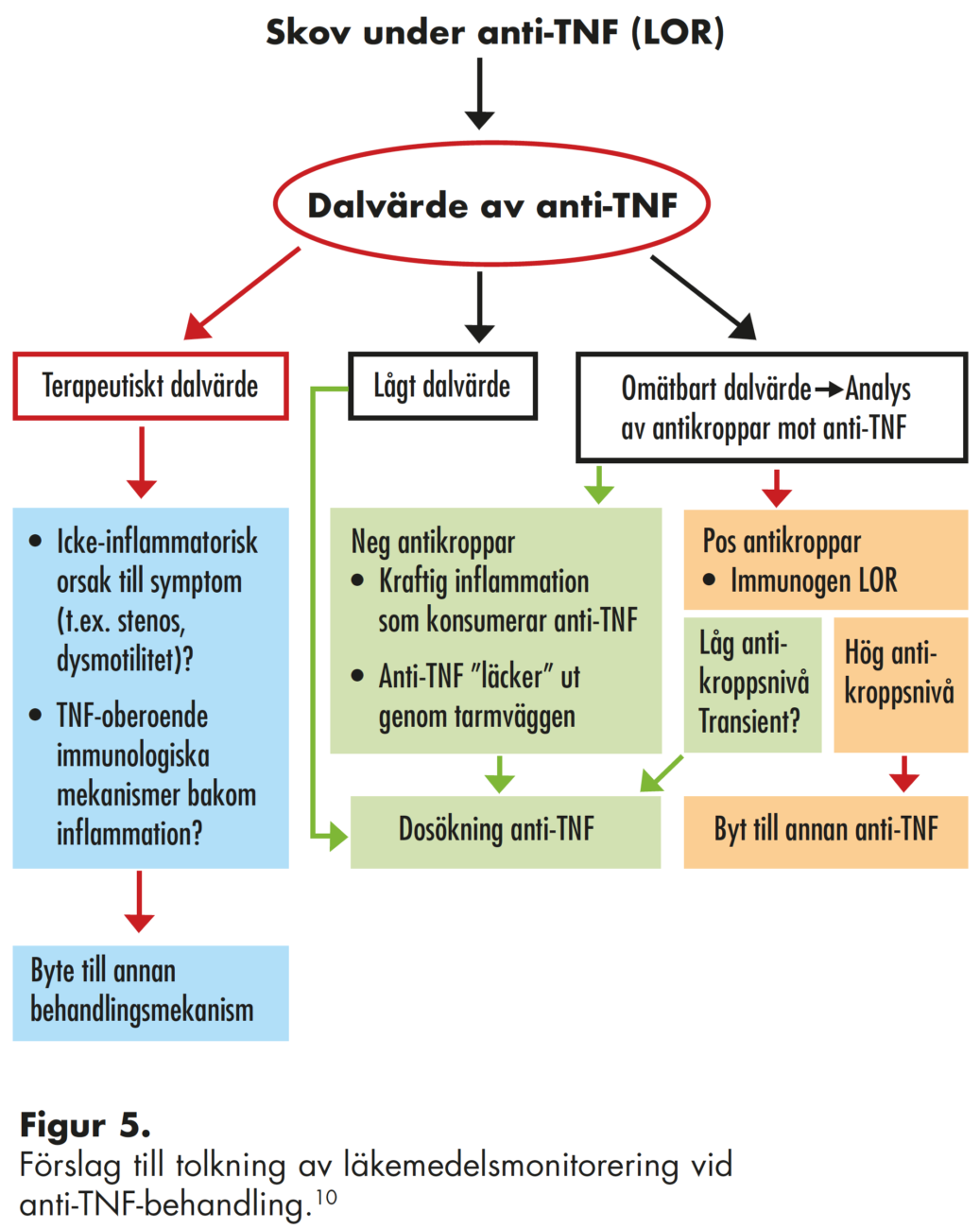
Behandlingssvikt under biologisk terapi
Vid biologisk behandling med anti-TNF-antikroppar ses ibland en sämre behandlingseffekt över tid, loss of response (LOR). Ettårsremission efter lyckad induktionsbehandling i de stora randomiserade studierna är runt 40 % vid CD, d.v.s. en stor del av de patienter som i början uppvisar god sjukdomslindring får symptomgenombrott inom ett år. Vid dessa situationer rekommenderas att man analyserar det bio-logiska läkemedlets dalvärde, d. v. s. serumnivåerna av anti-TNF-antikroppen omedelbart före nästa infusion/injektion. Om patienten uppvisar terapeutiska värden (riktvärden är 3–7 µg/ml infliximab, ≥5 µg/ml adalimumab – men är föremål för pågående diskussion) kan symptomen bero på icke-inflammatoriska komplikationer såsom strikturer, motilitetsstörning eller infektion. Det kan även föreligga TNF-oberoende inflammatorisk aktivitet. Vid låga dalvär-den kan det vara nödvändigt att öka doseringen, antingen genom att höja dosen eller täta intervallen (t.ex. ge 10 mg/kg infliximab alternativt ge infusion var 5:e–6:e vecka).
De flesta patienter bildar troligen en viss mängd endo-gena antikroppar som immunsvar mot givna biologiska läke- medel. Patientens egna antikroppar kallas ADAB/ADA – anti-drug-antibodies, ATI – antibodies toward inflixi-mab och AAA – antibodies against adalimumab. Det är dock endast i 6–17 % av fallen (varierar mellan olika studier) som dessa endogena ADAB når nivåer som har klinisk betydelse. ADAB kan undvikas genom att man ger infu- sionerna/injektionerna regelbundet och inte hoppar över doser. Kombinationsbehandling med immunmodulering (tiopuriner) minskar antikroppsbildningen. ADAB kan framförallt orsaka en betydligt snabbare eliminering av de infunderade anti-TNF-antikropparna. Ett alternativ för att undvika ADAB vid t ex intolerans mot tiopuriner och MTX är att monitorera dalvärdena och tillse att anti-TNF-koncen-trationen i blodet hålls i den övre delen av det terapeutiska intervallet. ADAB bidrar även till infusionsreaktioner. Om man har höga nivåer av ADAB brukar det inte hjälpa att höja dosen av det aktuella anti-TNF-läkemedlet. Dock kan man byta mellan infliximab, adalimumab och golimumab eftersom ADAB mot ett anti-TNF-läkemedel vanligvis inte korsreagerar med de andra. Man vet ännu inte betydelsen av läkemedelsnivåer och eventuell antikroppsbildning mot vedolizumab, men preliminära studier tyder på att dalvärdet vecka 6 (inför tredje infusionen) kan vara prediktivt för behandlingssvar. Monitorering av ustekinumab-behandling finns även tillgängligt vid vissa universitetssjukhus, men den vetenskapliga evidensen för direkt patientnytta saknas på grund av brist på kliniska studier.
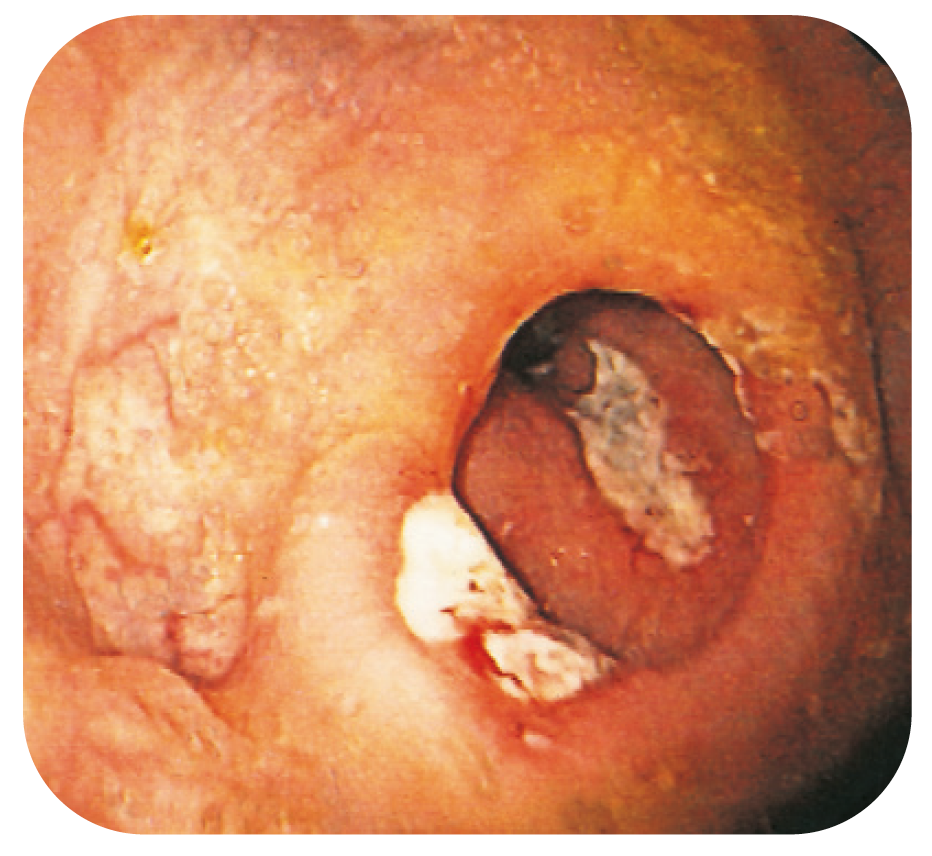
Bild 13.
Anastomosulcus och djupa ulcerationer även i neoterminala ileum hos CD-patient opererad med ileocekalresektion.
